Понимание того, что лечить онкологические заболевания можно иммунологическими методами, появилось довольно давно. Еще в конце XIX века американский хирург-онколог Уильям Коли обнаружил, что если делать инъекции инактивированных грамположительных и грамотрицательных бактерий, то у пациентов с саркомой сильно повышается температура, их состояние ухудшается, но у 25% после этого опухоль значительно сокращается в размерах, а отдельные пациенты выходят в полную ремиссию. Стало понятно, что стимуляция иммунной системы может быть хорошим способом противораковой терапии.
Потом интерес к иммунотерапии вновь возник в 1970-е годы, но и тогда прорывных работ не случилось. Интересно, однако, что когда стали анализировать материалы, связанные со вскрытием людей, погибших не по причине онкологических заболеваний, а по другим причинам, то 40% мужчин, считавшихся на момент смерти не страдавшими тем или иным видом рака, имели злокачественные опухоли предстательной железы.
Возникло предположение, что большая часть этих мужчин теоретически могла бы жить еще долгие годы, так и не узнав о своем заболевании, потому что их иммунная система находилась в состоянии баланса и вполне успешно сдерживала рост опухоли.
Стало ясно, что способность нашего иммунитета противостоять раку очень и очень велика, и медицина должна найти способ модифицировать и направить эту активность таким образом, чтобы добиться максимального эффекта в лечении.

– Ваша лаборатория занимается CAR–T-клеточной терапией. Это один из способов воздействия на иммунную систему пациента?
– Да, это именно так. CAR – это химерный рецептор антигена (Chimeric antigen receptor), искусственная белковая молекула, которая представляет собой химеру из нескольких белков.
Химерами называются организмы, разные клетки которых содержат генетически разнородный материал, в отличие от обычных организмов, у которых каждая клетка содержит один и тот же набор генов.
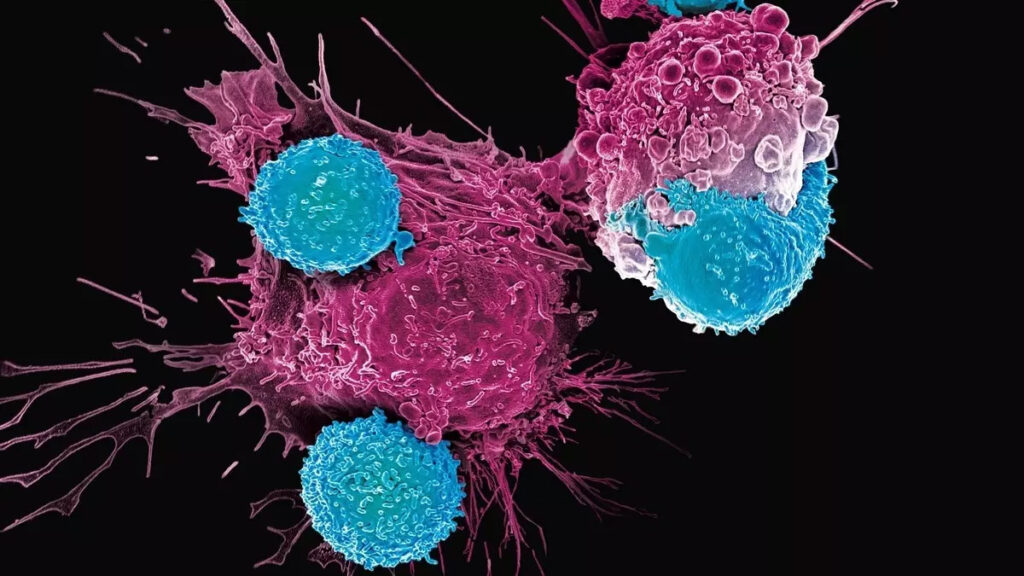
Наружная часть химерного антигенного рецептора – это антитело, то есть молекула, способная что-то опознать. В нашем случае она опознает поверхность раковой клетки, отличая раковую клетку от здоровой. Внутренняя же его часть запускает очень мощные сигналы.
Если мы конструируем Т-лимфоциты (клетки иммунной системы) с антигенным рецептором, то когда такой лимфоцит встречается с раковой клеткой, он нащупывает внешней частью детерминанту на клетке, лимфоцит понимает, что это клетка раковая, и уничтожает ее.
– А что такое детерминанта?
– Детерминанта – это молекула на поверхности клетки, которая характерна именно для этого вида рака, поэтому нам нужно точно знать, на что именно мы нацеливаем создаваемый нами CAR.
К сожалению, это является и ограничением метода, потому что для значительного количества видов рака такой отличительной молекулы на поверхности клетки просто нет, и в этом случае наш Т-лимфоцит не сможет отличить раковые клетки от здоровых клеток организма.
Когда же у нас есть четкий маркер, то при помощи сконструированного под него антигенного рецептора мы помогаем иммунной системе не раздумывать, а нападать на конкретного врага и уничтожать его.
Есть еще одна интересная особенность этой терапии. CAR-T-клетки не просто уничтожают злокачественные клетки, но еще и способны делиться! Если мы вводим пациенту 100 миллионов таких клеток, то они распределяются по организму, находят раковые клетки, начинают их уничтожать, и при этом через какое-то время самих CAR-T-клеток становится 10 миллиардов, 100 миллиардов и так далее. То есть мы имеем дело с лекарством, которое само размножается в организме человека.
Оно будет долго сохраняться и продолжать свою работу по уничтожению рака.
– Потрясающе! А как широко этот метод уже используется?
– Есть зарегистрированные препараты для лечения онкологических заболеваний, возникающих из В-лимфоцитов. Теоретически они доступны, но с целым рядом ограничений, связанных с несколькими обстоятельствами.
Понятно, что промышленное производство CAR-T-клеток по всем стандартам очень дорого. Необходимо произвести все реагенты для модификации Т-клеток, потом провести саму модификацию, так что себестоимость таких препаратов очень значительная, а после всех дополнительных накруток цена становится и совсем высокой. Наиболее известный препарат компании Novartis – Kymriah – стоит 350 000–450 000 долларов.
Есть и логистические сложности. Это не то лекарство, которое может лежать в аптеке в морозильнике. Терапия эта персонализированная, то есть делается под конкретного пациента. Сначала у него берутся его собственные Т-лимфоциты, затем они модифицируются, после чего их везут обратно и вводят пациенту. По сути, это не столько препарат, сколько медицинская процедура.
Как действует компания Novartis? Они собирают кровь пациентов в Европе, в своей лаборатории модифицируют их Т-клетки, проверяют их качество и затем доставляют каждому пациенту свой индивидуальный препарат. У них несколько центров в Европе, США, а сейчас они строят такой центр в Китае.
Здесь возникает проблема времени. В случаях тяжелых пациентов желательно ввести СAR-T-клетки как можно быстрее, но процесс может растянуться на три-пять недель.
CAR-T-клетки сегодня во всем мире становятся стандартом лечения онкогематологических заболеваний, но не первой линии. Из-за дороговизны процедуры ее назначают, только если больной не ответил ни на химиотерапию, ни на моноклональные антитела. При этом многие клиницисты говорят, что, если начать CAR-T-терапию пораньше, это было бы более мягкое для организма лечение, чем, например, использование высокодозной химии.
Но даже на терминальной стадии пациент может рассчитывать на хороший эффект от CAR-T-клеток. Ему вводят такой препарат, существенно снижают опухолевую нагрузку, а после этого направляют на трансплантацию гемопоэтических стволовых клеток. Эту процедуру можно считать отработанной.
В нашей стране CAR-T используют в Национальном медицинском исследовательском центре детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева в Москве. Практикует ее Михаил Александрович Масчан. Этим методом там воспользовались уже более 30 детей с очень хорошими результатами.
– Портал «Милосердие.ru» уже писал о том, что развитие CAR–T-клеточной терапии в нашей стране тормозится рядом бюрократических и финансовых барьеров.
– Да, это так. Для проведения клинических испытаний нужны инвестиции, инвестору необходимы хорошие результаты доклинических испытаний на человеке, для них требуются образцы препаратов, произведенные по всем стандартам GMP, а это тоже очень дорого. Мы попадаем в замкнутый круг, так что пока вынуждены работать на мышиных моделях.
Это международные стандарты надлежащей производственной практики (Good Manufacturing Practice).
Кроме того, наши Минздрав и Минобр приветствуют работы, являющиеся прорывными, содержащими нечто совершенно новое для всего мира. Если же мы работаем в направлении, определенном учеными других стран, к этому меньше интереса и поддержки.
Это неправильно. Посмотрим на Китай: там ученые начинают с копирования уже существующих образцов и, в процессе отработки заимствованной технологии, находят что-то новое. Это один из путей развития науки, и им нельзя пренебрегать. Китай знает об этом, и медицинская наука у них прекрасно развивается.
– Очень грустно, что так происходит, особенно в свете того, что ряд зарубежных фармацевтических и биотехнологических компаний уходит с российского рынка. Но продолжим про сам метод. Есть ли у него неприятные побочные эффекты?
– Главным образом это избыточно бурная реакция иммунной системы.
Благодаря ковиду теперь все знают, что такое цитокиновый шторм. Огромное количество активированных лимфоцитов в организме со страшной силой уничтожает раковые клетки и одновременно активирует и разнообразные клетки иммунной системы, что приводит к гипервоспалительной реакции.
Но тут, как правило, врачам удается купировать такой эффект, а применяют они те же самые средства, что и при ковиде.
Кстати говоря, первыми врачами, которые поняли, как бороться с цитокиновым штормом при ковиде, были именно онкогематологи, хорошо знакомые с таким эффектом.
– Все ли типы рака поддаются лечению методом CAR–T?
– Нет, не все. Дело в том, что не все виды раковых клеток имеют на поверхности специфический белок, отличающий их от клеток здоровых, а значит, мы не можем нацелить Т-лимфоциты на что-то конкретное.
К сожалению, в истории создания CAR-T-клеточной терапии были случаи гибели пациентов, когда тот белок, который определяли на поверхности раковой клетки, был и на поверхности здоровых клеток, и тогда нацеленные на него Т-лимфоциты разрушали и их.
– А это строго индивидуально? У каждого человека свои специфические белки на поверхности клеток или они одинаковые у всех для конкретного диагноза?
– Это общие характеристики для данного типа рака, и если для человека с таким диагнозом терапия оказалась безопасной, то она будет безопасной и для других пациентов с тем же диагнозом. Опасность остается лишь для первого применения терапии при каком-то виде рака.
Насколько бы хорошо ни была отлажена терапия на лабораторных животных, при переводе на человека все равно остается значительная доля неопределенности, хотя отчасти эта проблема уже решена. CAR-T-клетки снабжают специальным «переключателем», и в случае, если что-то пошло не так, их можно очень быстро при помощи него уничтожить. Пациенту вводят специальное вещество, на которое реагируют все CAR-T-клетки и погибают.
Еще одна сложность. Внутри одного человека не все раковые клетки могут быть одинаковы.
Допустим, мы делаем биопсию раковому больному и, к своей радости, находим на клетках маркер, который позволяет нам нацелить на него наши CAR-T-клетки. Делаем препарат, вводим его больному, но оказывается, что на миллион раковых клеток с этим маркером находится одна клеточка без него из-за какой-то мутации. Для CAR-T-клеток она будет выглядеть как здоровая, и они уничтожат миллион, а ее не тронут. Эта клетка начнет делиться, и через некоторое время заболевание вернется.
– А как обстоит дело с видами злокачественных новообразований помимо онкологических заболеваний крови?
– При онкогематологических заболеваниях CAR-T-клеткам гораздо легче обнаруживать и уничтожать отдельные опухолевые клетки, которые не слиплись.
Что же касается сόлидных типов рака, как например, рак предстательной железы, которым мы занимаемся в нашей лаборатории, тут успехи гораздо скромнее.
Злокачественные болезни крови относятся к группе гемобластозов. Их особенностью является повсеместное распространение по организму, без образования локализованных очагов. Все остальные опухоли относятся к сόлидным (от английского solid – твердый). Это разрастания в виде уплотнений или утолщений.
Типичная картина клинических испытаний CAR-T при таких опухолях выглядит так: 10 пациентов пролечили, пятеро не ответили на лечение совсем, трое ответили слабо, двое – чуть лучше, но опухоль не пропала.
Проблема в том, что внутри опухоли среда для CAR-T-клеток очень неблагоприятная. Живым клеткам необходим кислород, глюкоза, правильный баланс ионов, а в опухоли все не так: нет ни кислорода, ни глюкозы, калия больше, чем нужно, натрия меньше, чем нужно. А еще внутри опухоли часто бывают иммуносупрессивные молекулы, которые угнетают активность лимфоцитов. В результате внутри такой опухоли CAR-T-клетки не выживают.
Над этой проблемой сейчас работают ученые. Один из вариантов решения – создание такой модификации Т-лимфоцита, которая стала бы стрессоустойчивой, и хотя реальных прорывов пока что нет, нам понятно направление, в котором необходимо двигаться.
– Над чем вы работаете сегодня?
– Мы работаем в двух направлениях. Одно ближе к фундаментальной науке, другое – к прикладной.
Первое связано с попыткой создать такие CAR-T-клетки, которые бы опознавали не один, а два белка на поверхности раковой клетки, чтобы уменьшить их способность прятаться от модифицированных Т-лимфоцитов. Допустим, клетка мутировала, и один из белков пропал, тогда наш CAR будет искать второй белок и все равно сможет уничтожить клетку.
Получить бифукциональный CAR – это работа на перспективу.
Вторая цель – это создать CARы, которые смогли бы начать работать уже в ближайшем будущем.
Мы проводим эксперименты на специальной модели мышей без иммунной системы и прививаем ей клетки человеческого острого лимфобластного лейкоза В-клеточного происхождения.
Специальная модель мышей без иммунной системы нужна потому, что иммунная система животного сразу же опознает человеческие раковые клетки как чужие и начнет их уничтожать.
У здорового добровольца мы берем Т-клетки, модифицируем их, и, когда у мыши опухоль уже достаточно развилась, вводим ей CAR-T-клетки. Мы наблюдаем, что у таких животных происходит размножение CAR-T-клеток и снижение опухолевой нагрузки. Мыши начинают поправляться.
Значит ли это, что все именно так и произойдет с больным человеком? К сожалению, наверняка мы этого пока не знаем, так как мышь моделирует человека лишь частично, но результаты воодушевляют.
Вот еще интересный пример. У мышей не бывает рака простаты, но мы используем модель человеческого рака простаты у мышей-самцов. Созданные нами CAR-T-клетки достаточно эффективно у них сработали, но мы опять же пока что не можем быть полностью уверены в том, что такой же результат будет и у человека.
– Как вы думаете, получится ли в итоге приспособить эту терапию для лечения солидных опухолей?
– Еще пять лет назад я бы ответил «да». Я тогда действительно считал, что CAR-T-клетки – это лекарство от всех типов рака. Сегодня я понимаю ограничения метода, однако огромным прогрессом стало то, что если пять лет назад случаи излечения были единичными, то теперь при помощи этой технологии тысячи людей избавляются от рака.
Важно, что сегодня мы знаем, как именно нужно модифицировать клетку, чтобы она выживала и работала в солидных опухолях. Вполне вероятно, что со временем мы научимся это делать.
– В конце 2021 года в «Журнале персонализированной медицины» (Journal of Personalized Medicine) была опубликована ваша статья про CAR-NK-клеточную терапию как потенциально эффективный и более дешевый метод лечения раковых заболеваний. Как далеко продвинулись эти исследования?
NK-клетки (Natural killer cells) – естественные (натуральные) киллеры. Это тип лимфоцитов, являющийся частью врожденного иммунитета. NK-клетки обеспечивают ответ на заражение внутриклеточными бактериями и вирусами, уничтожая инфицированные клетки, а также принимают участие в работе противоопухолевого иммунитета.
– С NK-клетками мы только начинаем работать. Интерес к ним связан с тем, что именно они в организме контролируют онкопроцессы. Они определяют злокачественные клетки не по одному специфическому маркеру, а по совокупности характеристик, по паттерну поверхности клетки, поэтому они уже сами по себе имеют склонность к уничтожению раковых клеток. Если же мы их дополнительно модифицируем, то сможем добиться еще лучшего результата.
С NK-клетками, однако, есть свои сложности. Они хуже поддаются модификации, поэтому во всем мире прошли тысячи клинических испытаний CAR-T-клеток, а продукты с NK-клетками еще только-только начинают опробоваться, так что мы в самом начале пути.
Интерес к этому большой, потому что NK-клетки можно трансплантировать неродственным донорам, а это значительно упрощает и удешевляет процедуру.
А еще они важны для лечения раков Т-клеточного происхождения, которые сложны для CAR-T-клеточной терапии, именно этим и занимается сейчас наша группа. Мы исследуем эффективность CAR-NK-клеток в лечении довольно редкого заболевания – острого лимфобластного лейкоза Т-клеточного происхождения.